LINK PUBLICACIÓN
Calidad de las proteínas de los insectos como ingredientes potenciales para alimentos para perros y gatos
Publicado en línea por Cambridge University Press: 25 de septiembre de 2014
Abstracto
Los insectos se han propuesto como una fuente de proteína dietética sostenible, eficiente y de alta calidad. El presente estudio evaluó la calidad de la proteína de una selección de especies de insectos. Los sustratos de insectos fueron pupas de mosca doméstica, grillos domésticos adultos, larvas de gusano de la harina amarillo, larvas de gusano de la harina menor, larvas de gusano Morio, larvas y pupas de mosca soldado negra, cucaracha de seis manchas, cucaracha cabeza de muerte y cucaracha argentina. Los sustratos de referencia fueron harina de carne de ave, harina de pescado y harina de soja. Se analizaron los contenidos de MS, N, grasa cruda, cenizas y aminoácidos (AA) de los sustratos y la digestibilidad in vitro de la materia orgánica (MO) y N. La composición de nutrientes, las puntuaciones de AA y la digestibilidad in vitro de MO y N variaron considerablemente. entre sustratos de insectos. Para la puntuación AA, el primer AA limitante para la mayoría de los sustratos fue el requisito combinado de Met y Cys. Las pupas de la mosca doméstica y de la mosca soldado negra tenían un alto contenido de proteínas y puntuaciones altas de AA, pero eran menos digeribles que otros sustratos de insectos. El contenido de proteínas y la puntuación AA de los grillos domésticos fueron altos y similares a los de la harina de pescado; sin embargo, la digestibilidad del N in vitro fue mayor. Las cucarachas tenían un contenido relativamente alto de proteínas, pero el contenido indispensable de AA, las puntuaciones de AA y los valores de digestibilidad in vitro eran relativamente bajos. Además de los índices de calidad de las proteínas, otros aspectos como la eficiencia de la conversión de corrientes secundarias orgánicas, la viabilidad de la producción en masa, la seguridad del producto y la percepción de los dueños de mascotas son importantes para la futura aplicación de insectos en alimentos para perros y gatos como fuente alternativa de proteínas.
Las tendencias hacia 2050 predicen una mayor demanda de fuentes de proteínas de origen animal para alimentos humanos debido a los efectos combinados del aumento de la población humana y el aumento de los niveles de vida en los países en desarrollo ( Referencia Boland, Rae y Vereijken1 ) . Esta demanda aumentará la competencia global por las proteínas en los alimentos para humanos, mascotas y ganado y estimulará el desarrollo de fuentes de proteínas alternativas y sostenibles para garantizar la seguridad alimentaria. La Organización de las Naciones Unidas para la Alimentación y la Agricultura ha destacado el potencial de los insectos como fuente de alimentos y piensos ( Referencia Van Huis, Van Itterbeeck y Klunder2 ) . Los insectos son en general proteicos ( Referencia Rumpold y Schlüter3 ) y algunas especies pueden cultivarse eficientemente en corrientes secundarias orgánicas, lo que las convierte en alternativas potencialmente sostenibles para los ingredientes proteicos actuales de los piensos ( Referencia Rumpold y Schlüter3 – Referencia Veldkamp, van Duinkerken y van Huis5 ) . Además, los insectos son comúnmente consumidos por gatos salvajes en todo el mundo y contribuyen hasta el 6% de su dieta ( Referencia Plantinga, Bosch y Hendriks6 ) . Sin embargo, actualmente la información sobre la calidad de las proteínas es limitada para la mayoría de las especies de insectos. Por lo tanto, el objetivo del presente estudio fue evaluar la calidad de las proteínas de una selección de especies de insectos como ingredientes potenciales para alimentos para perros y gatos.
Metodos experimentales
Sustratos
Los sustratos de insectos fueron pupas de mosca doméstica ( Musca domestica ) (donada por Jagran BV Hillegom), grillo doméstico adulto ( Acheta domesticus ), larvas de gusano amarillo de la harina ( Tenebrio molitor ), larvas de gusano menor de la harina ( Alphitobius diaperinus ), larvas de gusano Morio ( Zophobas morio ) (todos comprado en Kreca), larvas y pupas de mosca soldado negra ( Hermetia illucens ) (donadas por el Laboratorio de Entomología de la Universidad de Wageningen) y cucaracha adulta de seis manchas ( Eublaberus distanti ), cucaracha cabeza de muerte adulta ( Blaberus craniifer ) y cucaracha argentina hembra adulta ( Blaptica dubia ) (donado por DGAB Oonincx). Las larvas de la mosca soldado negra fueron alimentadas con una dieta inicial para pollos de engorde (Agruniek Rijnvallei Voer BV) y las cucarachas fueron alimentadas con desperdicios de comida domésticos. Las otras especies de insectos procedían de empresas que mantienen la confidencialidad de la composición de la dieta. Los sustratos de referencia fueron harina de carne de ave (Sonac), harina de pescado (Research Diet Services) y harina de soja (Research Diet Services). Se liofilizaron pupas de mosca doméstica, larvas de mosca soldado negra y pupas y cucarachas hasta un peso constante. Los grillos domésticos, los gusanos amarillos, los gusanos menores y los gusanos Morio ya estaban liofilizados. El estiércol de ave restante adherido a las pupas de mosca doméstica y la tierra adherida a las pupas de mosca soldado negra se eliminaron a mano. Antes de la molienda, se trituraron pupas de mosca doméstica, gusanos Morio, larvas y pupas de mosca soldado negra y cucarachas con un molino ultracentrífugo sin tamiz (Retsch ZM 100, F. Kurt Retsch GmbH& Co. KG). A continuación, estos insectos se trituraron en un molino analítico de laboratorio (A10, Janke & Kunkel GmbH u. Co KG), excepto los grillos domésticos, que se trituraron en un molino centrífugo con un tamiz de 1 mm (Retsch ZM 100). Los sustratos de referencia ya estaban secos y molidos.
Digestión in vitro
Los sustratos se digirieron in vitro según un método de dos pasos de Boisen mejorado ( Referencia Boisen y Fernández7 ) con modificaciones ( Referencia Hervera, Baucells y Blanch8 , Referencia Jha, Bindelle y Van Kessel9 ) simulando los procesos digestivos gástricos y del intestino delgado caninos. Se añadió cloranfenicol durante la incubación por su efecto antibiótico. El número de incubaciones repetidas necesarias se calculó sobre la cantidad prevista de residuo por repetición y la cantidad total de residuo necesaria para los análisis químicos. Los sustratos (10 g) se incubaron en vasos de precipitados con una solución tampón fosfato (250 ml, 0,1 m , pH 6,0) y una solución de HCl (100 ml, 0,2 m ). El pH se ajustó a 2,0 con HCl 1 m o NaOH 10 m . Se añadieron solución de pepsina fresca (10 ml, 25 g/l, pepsina porcina 2000 FIP U/g, Merck 7190) y 10 ml de solución de cloranfenicol (0,005 g/mol de etanol) y cada vaso de precipitado se cubrió con un glaseado y se colocó en una cámara de calentamiento a 39°C durante 2 h bajo agitación magnética constante. Luego, se añadieron a la solución90 ml de tampón fosfato (0,2 m , pH 6,8) y 50 ml de NaOH 0,6 m . El pH se ajustó a 6,8 con HCl 1 m o NaOH 10 m . Se añadió solución de pancreatina fresca (10 ml, 100 g/l de pancreatina, páncreas porcino grado VI, SigmaP-1750) y la incubación continuó durante 4 h en las mismas condiciones. Después de la incubación, los residuos se recogieron mediante filtración de las suspensiones sobre una gasa de nailon (37 µm) plegada en un embudo de porcelana Büchner. La muestra se lavó dos veces con acetona (99,5 %) seguida de etanol (96 %). Luego, la tela con el residuo se colocó temporalmente sobre un papel limpio para evaporar el etanol/acetona restante durante la noche. El residuo se recogió de la tela de nailon y se secó a 70°C durante la noche en un frasco previamente pesado. Luego se volvieron a pesar los frascos secados al horno para determinar la cantidad de residuo seco para cada réplica, lo que permitió calcular la digestibilidad de la MS para cada réplica. Para cada tipo de sustrato, los residuos seleccionados secados en horno se combinaron y se molieron en un molino analítico de laboratorio (A10, Ika-Werk). Los residuos molidos se transfirieron a un frasco nuevo, en espera de análisis químicos adicionales para calcular la digestibilidad de MS, materia orgánica (MO) y N in vitro para cada sustrato.
Análisis químicos
La MS y las cenizas se determinaron secando hasta peso constante a 103°C y quemando a 550°C, respectivamente. El nitrógeno se determinó mediante el método de Kjeldahl ( 10 ) y la grasa bruta se analizó según el método de Berntrop ( 11 ) . Los aminoácidos (AA) se analizaron mediante cromatografía de intercambio iónico y derivatización con ninhidrina ( 12 ) .
Cálculos
El contenido de MO se calculó a 100 – contenido de cenizas (porcentaje de MS). La proteína cruda (PB) se calculó como 6,25 × N y el contenido de AA se expresó como porcentaje de PB. La digestibilidad del sustrato OM y N se calculó como la cantidad de residuo recolectado (en g MS) × contenido en residuo (en porcentaje de MS)/cantidad de sustrato incubado (en g MS) × contenido en sustrato (en porcentaje de MS) ). Las puntuaciones AA se calcularon como se describe en Kerr et al. ( Referencia Kerr, Beloshapka y Morris13 ) utilizando requisitos mínimos para el crecimiento de gatitos y cachorros ( 14 ) como valores de referencia.
Resultados y discusión
Los contenidos de proteínas y grasas variaron considerablemente entre los sustratos de insectos ( Tabla 1 ). El contenido de PB de los sustratos de insectos fue en general mayor que el de la harina de soja y cercano al de la harina de carne de ave y de pescado. Los grillos domésticos contenían la mayor cantidad de CP, seguidos por los gusanos de la harina y las cucarachas. El contenido de grasa osciló entre 12,8 y 39,6 % de la MS para las larvas de mosca soldado negra y gusanos Morio, respectivamente. El contenido de ceniza cruda de los sustratos de insectos estuvo entre 3,0 y 5,6 % de la MS, excepto para las larvas y pupas de la mosca soldado negra que contenían alrededor del 13 %.
El contenido de cenizas de las larvas de mosca soldado negra oscilaba en la literatura entre 9,0 y 14,6 % de MS ( Referencia Finke15 , Referencia Newton, Booram y Barker16 ) y 15,5 % de MS en prepupas ( Referencia St-Hilaire, Sheppard y Tomberlin17 ) . Los contenidos de Phe y Met de CP variaron más entre los sustratos de insectos, y los contenidos más altos se encontraron en las pupas de mosca doméstica. Las pupas de mosca doméstica también tenían un alto contenido de Lys, al igual que los gusanos de la harina menores. Los grillos domésticos eran relativamente altos en Arg pero bajos en His. Como se ha sugerido que la PC se aproxima a la proteína verdadera para la mayoría de las especies de insectos ( Referencia Finke18 ) , los AA se expresaron en función de la CP para obtener información sobre la calidad de la proteína. La quitina contribuye al N no proteico y aporta entre el 1 y el 7 % del N de todo el cuerpo ( Referencia Finke18 ) .
Las diferencias en el contenido de quitina de los sustratos de insectos pueden confundir la estimación de la calidad de las proteínas. Los contenidos de AA para especies de insectos varían considerablemente entre los estudios. Por ejemplo, para los grillos domésticos, el contenido de Arg en el presente estudio (5,7 % de PB) estuvo dentro del rango de otros estudios ( Referencia Rumpold y Schlüter3 ) (4,9–6,0 % de CP) pero His fue mayor (3,4 vs. 2,1–2,6 % de CP). Dependiendo de la dieta suministrada, el contenido de Met de los gusanos amarillos de la harina osciló entre 0,48 y 1,80 % de la PB ( Referencia Ramos-Elorduy, González y Hernández19 ) .
Para la aplicación de insectos como fuente de proteínas en alimentos o piensos para mascotas, sería importante monitorear y controlar la variación en la composición de AA. Met y Cys en la harina de carne de ave fueron menores en el presente estudio que lo informado en la literatura, es decir, 1,05 frente a 1,07 % en Clapper et al. ( Clapper de referencia, Grieshop y Merchen20 ) al 2,11 % en Johnson et al. ( Referencia Johnson, Parsons y Fahey21 ) y 0,69 % (datos no mostrados) versus 1,34 % en Clapper et al. ( Clapper de referencia, Grieshop y Merchen20 ) al 2,66 % en Murray et al. ( Referencia Murray, Patil y Fahey22 ) , respectivamente. Para la puntuación AA, el primer AA limitante para la mayoría de los sustratos fue el requisito combinado de Met y Cys. Las puntuaciones AA más altas se encontraron en las pupas de mosca doméstica, seguidas por las pupas de mosca soldado negra y el gusano Morio y las puntuaciones más bajas en las cucarachas.
Tabla 1.Composición aproximada (porcentaje de MS), composición de aminoácidos indispensables (porcentaje de PB) y puntuación de aminoácidos (AA) de insectos y sustratos de referencia
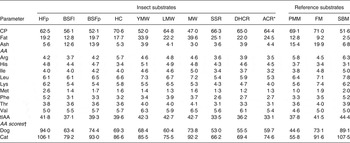
PB, proteína cruda; HFp, pupas de mosca doméstica; BSFl y BSFp, larvas y pupas de mosca soldado negra; HC, grillo doméstico; YMW, gusano amarillo de la harina; LMW, gusano menor de la harina; MW, gusano Morio; SSR, cucaracha de seis puntos; DHC, cucaracha cabeza de la muerte; ACR, cucaracha argentina; PMM, harina de carne de ave; FM, harina de pescado; SBM, harina de soja; tIAA, aminoácidos indispensables totales.
†Calculado como se describe en Kerr et al. ( Referencia Kerr, Beloshapka y Morris13 ) utilizando requisitos mínimos para el crecimiento de gatitos y cachorros ( 14 ) como valores de referencia.
La digestibilidad de la MO in vitro fue mayor para los gusanos amarillos, los gusanos Morio y los gusanos menores ( Tabla 2 ). Las pupas de la mosca soldado negra tuvieron la digestibilidad de la MO in vitro más baja y fue 16,2 % menor que la de las larvas. Esta diferencia en la digestibilidad probablemente se deba a una mayor esclerotización de las proteínas cuticulares en las pupas. La digestibilidad del N in vitro fue relativamente alta para los grillos domésticos, los gusanos amarillos de la harina, los gusanos menores de la harina y los gusanos Morio y baja para las pupas de la mosca soldado negra, la cucaracha de seis manchas y la cucaracha cabeza de muerte. La información sobre la digestibilidad de las especies de insectos evaluadas es limitada en la literatura. La digestibilidad aparente del N fecal de una dieta que contenía 33 % de harina de larvas de mosca soldado negra como principal fuente de proteína fue de 76,0 % en cerdos castrados de 8,2 a 14,7 kg ( Referencia Newton, Booram y Barker16 ) y una dieta que contenía 50 % de harina de pupas de mosca doméstica tenía una digestibilidad fecal aparente de N de 79,0 % en pollos de engorde ( Referencia Pretorius23 ) .
Tabla 2. Digestibilidad in vitro (%) de insectos y sustratos de referencia.
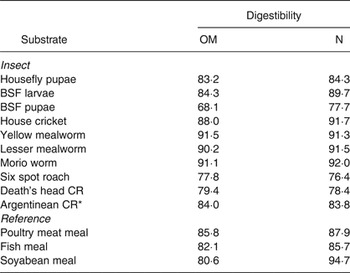
MO, materia orgánica; BSF, mosca soldado negra; CR, cucaracha.
Los sustratos de insectos seleccionados difirieron considerablemente en la composición de nutrientes, así como en la digestibilidad de la MO y el N in vitro . De los sustratos de insectos estudiados, las pupas de la mosca doméstica y la mosca soldado negra tenían un alto contenido de PC y puntuaciones altas de AA, pero eran menos digeribles que los otros sustratos de insectos. El contenido de PB y la puntuación de AA de los grillos domésticos fueron altos y similares a los de la harina de pescado, pero con una digestibilidad de N in vitro ligeramente mayor . Las cucarachas tenían un contenido relativamente alto de PB, pero los contenidos indispensables de AA, las puntuaciones de AA y los valores de digestibilidad in vitro eran relativamente bajos. Junto a estos índices de calidad proteica, otros aspectos como la eficiencia de conversión de corrientes secundarias orgánicas ( Referencia Van Huis, Van Itterbeeck y Klunder2 , Referencia Rumpold y Schlüter24 ) , viabilidad de la producción en masa ( Referencia Rumpold y Schlüter24 ) , seguridad del producto ( Referencia Rumpold y Schlüter24 , Referencia van der Spiegel, Noordam y van der Fels-Klerx25 ) y la percepción de los dueños de mascotas determinarán si se utilizan especies de insectos en futuras formulaciones de alimentos para mascotas. Estos y otros aspectos requieren mayor estudio.
Agradecimientos
Esta investigación fue financiada por la Universidad de Wageningen. Todos los autores contribuyeron fundamentalmente al presente manuscrito. GB contribuyó en todas las facetas, incluidas las preguntas y el diseño de la investigación, la ejecución del estudio, el análisis de los datos y la redacción del manuscrito inicial. SZ contribuyó a la ejecución del estudio, analizando los datos y escribiendo el manuscrito. DGABO contribuyó al diseño de la investigación, interpretación de datos y preparación de manuscritos. WHH contribuyó a conseguir financiación, interpretación de datos y preparación de manuscritos. No hay conflictos de intereses que declarar.
Este artículo fue publicado como parte de las Actas del Simposio Internacional de Ciencias de la Nutrición de WALTHAM 2013, cuya publicación fue financiada por una subvención educativa sin restricciones de Mars Incorporated. Los artículos incluidos en estas actas fueron invitados por el editor invitado y se sometieron al proceso de revisión formal estándar de una revista. Pueden ser citados.
